Джимак С.С., Барышев М.Г., Басов А.А.1ФГБОУ ВПО Кубанский государственный университет,
Южный научный центр РАН, лаборатория «Проблем природных и новых материалов», 350040, Россия, Краснодар, ул. Ставропольская, 149,
E-mail: jimack@mail.ru
1ФГБОУ ВПО Кубанский государственный медицинский университет Минздравсоцразвития, 350063, Россия, Краснодар, ул. Седина, 4
Существование организма человека в условиях постоянного контакта с неблагоприятными факторами внешней среды невозможно без адекватного функционирования его неспецифических защитных систем. Ослабление неспецифической резистентности организма наблюдается при многих патологических и особых физиологических состояниях, что характеризуется снижением адаптационно-приспособительных реакций и способствует различным нарушениям гомеостаза, приводящим к неблагоприятным исходам заболеваний, снижению умственной и физической работоспособности. Одной из ключевых систем неспецифической защиты является антиоксидантная система (АОС), обеспечивающая поддержание соотношения прооксидантных и антиоксидантных факторов в организме на физиологическом уровне [1, 2]. Несмотря на то, что прооксиданты – свободные радикалы (супероксидный анион-радикал, оксид азота, гидроксильный радикал, алкилы, алкоксилы, пероксилы) и реактивные молекулы (пероксид водорода, гипохлорит-анион, гидропероксиды, пероксинитрит) – принимают активное участие в регуляции многих внутриклеточных процессов [3-7], включая иммунные механизмы, обезвреживание ксенобиотиков, апоптоз, метаболизм биологически активных соединений (простагландинов, биоаминов), обмен костной ткани и окисление гемоглобина, в случаях развития в организме дисбаланса прооксидантно-антиоксидантной системы с преобладанием прооксидантных факторов, последние начинают оказывать повреждающее действие на молекулярном и клеточном уровне, что сопровождается комплексом типовых патологических изменений в органах и тканях, называемых термином «окислительный стресс» [8, 9].
Принимая во внимание большую роль реакций свободнорадикального окисления (СРО) в регуляции физиологических процессов и развитии патологических состояний, в современной биологии, профилактической и клинической медицине продолжается активный поиск способов фармацевтической и немедикаментозной коррекции нарушений, развивающихся в условиях окислительного стресса (ОС), что позволит предупредить формирование или уменьшить количество осложнений при целом ряде заболеваний (сахарный диабет, атеросклероз, бронхиальная астма, онкопатология, ревматоидный артрит, нейродегенеративные и другие заболевания), в патогенезе которых ОС играет существенную роль [10-14]. Значительный интерес представляет возможность нутриционной коррекции нарушений окислительного метаболизма в организме, что, прежде всего, обусловлено способностью пищевых веществ оказывать существенное влияние на здоровье, работоспособность и продолжительность жизни, поэтому в настоящее время, помимо, оптимального соотношения пищевых веществ и минеральных компонентов, проводится и оценка их влияния на показатели эндогенной АОС [15-17]. Одним из перспективных пищевых веществ для коррекции антиоксидантного потенциала организма является вода с модифицированным изотопным составом (ВМИС), например, вода с пониженным содержанием дейтерия [18]. Известно, что человек в физиологических условиях потребляет до 2-3 литров жидкости в сутки, поэтому изменение структуры питания за счет ВМИС с пониженным содержанием дейтерия может оказывать влияние на показатели АОС. Во всем мире в последние годы достаточно активно изучаются различные эффекты ВМИС с пониженным содержанием дейтерия – основное ее действие на организм заключается в постепенном снижении содержания дейтерия в биологических жидкостях и тканях за счёт реакций изотопного обмена. В научной литературе чаще описаны биологические эффекты ВМИС, тогда как молекулярные механизмы ее действия на организм еще полностью не исследованы. ВМИС с пониженным содержанием дейтерия оказывает влияние на рост опухолевых клеток различных культур [19-21], обладает иммуномодулирующим свойством [22-24], влияет на обмен пероксида водорода в печени [25]. Все вышеперечисленные примеры показывают, насколько велика роль изотопного состава воды для молекулярных процессов в организме, а, следовательно, при введении ВМИС с пониженным содержанием дейтерия в рацион питания людей при состояниях, сопровождающихся развитием ОС, возможно повышение потенциала эндогенной АОС и предупреждение осложнений [26]. Таким образом, все более широкое использование ВМИС с пониженным содержанием дейтерия как у людей с различными патологическими состояниями, так и для оздоровления (фитнес), а также в профессиональном спорте, требует детального изучения молекулярных механизмов ее действия, что позволит более рационально использовать ее эффекты для профилактики и в клинических условиях.
Цель исследования: выявление изменений количественного содержания дейтерия, интенсивности свободнорадикального окисления и состояния антиоксидантной системы крови, а также влияния воды с модифицированным изотопным составом с пониженным содержанием дейтерия на показатели свободнорадикального окисления тканей у лабораторных животных в физиологических условиях и при воспалительных процессах.
Материалы и методы
Объектом исследования была кровь и гомогенаты органов (печень, почки) крыс-самцов весом 90-100 грамм. Крысы были разделены на следующие группы: группа №1 (получающие дистиллированную минерализованную воду (158 ppm) в течение 30 дней, n=40), группа №2 (получающие дистиллированную минерализованную воду (158 ppm) в течение 30 дней, имеющие гнойное воспаление мягких тканей, n=40), группа №3 (получающие дистиллированную минерализованную воду с пониженным содержанием дейтерия (40 ppm) в течение 30 дней, имеющие гнойное воспаление мягких тканей, n=40).
Воду с пониженным содержанием дейтерия получали на установке, разработанной в Кубанском государственном университете [27, 28]. Исходная концентрация дейтерия в получаемой воде составляла 40 ppm.
При моделировании гнойной раны у крыс, использовали двухэтапную модель окислительного стресса. Первый этап представлял собой острую фазу окислительного стресса и моделировался путем создания межмышечного абсцесса в мягких тканях длинных мышц спины лабораторного животного с использованием имплантированного инородного тела. Второй этап отражал хроническую фазу окислительного стресса и моделировался гнойной раной, которая формировалась естественным образом при дренировании абсцесса и удалении инородного тела.
Основой модели окислительного стресса явилась известная модель раневого процесса, предложенная Л.А.Мамедовым и основанная на хирургическом лечении модели абсцесса, нами в ходе экспериментальных исследования проведена ее модификация [29].
Для создания модели абсцесса крысе до начала эксперимента срезали и выбривали шерсть на средней и нижней третях спины. Затем под местной анестезией р-ром новокаина 0,5% - 10 мл иглой шприца наносилось повреждение мягких тканей (область длинных мышц спины) на глубине 3 см шириной 2 см в предполагаемой зоне формирования абсцесса. В день начала эксперимента под хлоралозо-нимбуталовым наркозом производился разрез скомпрометированной накануне области длиной 3 см и в мягкие ткани вводился стерильный марлевый шарик диаметром 10 мм, пропитанный 1 мл жидкости с патогенным штаммом
St. aureus. На рану накладывались первичные швы.
Через сутки у животных появлялась клиника нагноения раны и начинался первый (острый) период моделирования окислительного стресса. Швы снимались через 5 суток с момента инфицирования, что соответствовало переходу во вторую фазу окислительного стресса. В дальнейшем проводилось местное лечение гнойной раны под мазевыми повязками до ее полного заживления вторичным натяжением.
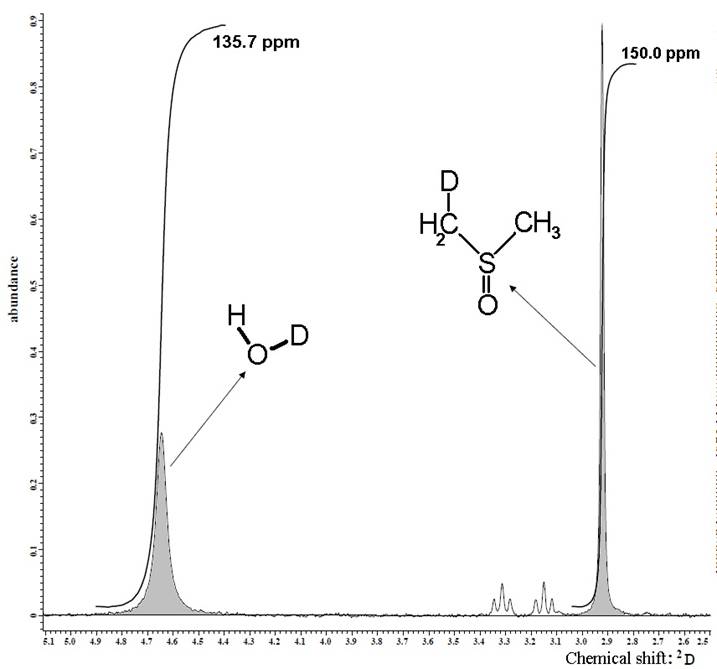 |
Рис. 1. Соотношения интегральных интенсивностей 2D ЯМР сигнала HDO, относительно 2D ЯМР сигнала DMSO-D1.
|
Определение концентрации дейтерия в плазме были проведены с помощью ядерного магнитного резонанса (ЯМР) на импульсном ЯМР-спектрометре
JEOL JNM-ECA 400MHz. Съёмку спектров проводили на соответствующей резонансной частоте ядер дейтерия – 61.4 MГц. Параметры съёмки: 6.7 с (
acquisition time), 20 с (
relaxation delay), 5.6 мкс (x-pulse), 0.15 Гц (resolution). Температура съёмки – 25 ◦C, при этом точность стабилизации 0.2 ◦C. Измерения проводились с использованием 5 мм ампулы, внутри которой был строго зафиксирован запаенный капилляр, содержащий откалиброванную в определяемой концентрационной шкале смесь дейтерированного и недейтерированного диметилсульфоксида (
DMSO), дающего 2D ЯМР сигнал в области 3,4 м.д. (относительно (СD3)4Si), в то время как 2D ЯМР сигнал HDO находится в области 4,7 м.д. (относительно (СD3)4Si) (рис. 1).
Обработка полученных спектров заключалась в определении соотношения интегральных интенсивностей 2D ЯМР сигнала HDO, содержащейся в исследуемом образце относительно 2D ЯМР сигнала DMSO-D1, интенсивность которого, в свою очередь, была определена при таких же условиях относительно стандартов – образцов воды с точно определённым содержанием дейтерия (3.7 ppm, 51 ppm, 150 ppm). Измерения каждого образца проводились неоднократно для уменьшения погрешностей эксперимента. При этом точность определения содержания дейтерия в биологических образцах составила ± 2 ppm.
Для определения изотопного состава лиофилизированных органов лабораторных животных использовался масс-спектрометр DELTA
plus, снабженный периферийным устройством для пробоподготовки воды к изотопному анализу водорода H/Device (Finnigan, Германия). Твердые образцы заворачивались в металлическую фольгу и помещались в камеру сгорания с помощью автоматического пробоотборника Carlo Erba AS 200-LS. Изменение изотопного состава выражали в промилле (‰; часть на тысячу) с использованием стандартного дельта-обозначения (δ).
Калибровка измерений в твердых образцах выполнялась относительно международного образца (IAEA-CH-7, δD=-100,3‰) и различных внутренних проверенных стандартов. Точность измерений составляла ~±2‰ для твердого вещества.
Измерение спектров электронного парамагнитного резонанса (ЭПР) проводили при комнатной температуре на спектрометре JES Fa 300 (JEOL, Япония) в X-диапазоне. Условия измерения: СВЧ мощность 1 мВт, частота микроволнового излучения 9144 МГц, амплитуда высокочастотной модуляции 0,1 мТл. Образцы тканей предварительно подвергали лиофилизации (в лиофильной сушилке ЛС-1000), измеряли в кварцевой ампуле (5 мм), масса навески в зоне резонатора составляла 0,0300 г. Концентрацию парамагнитных центров (ПМЦ) в образцах определяли путем сравнения с сигналом стандартного образца (
TEMPOL). Интегральную интенсивность сигнала ЭПР в исследуемых образцах определяли путем двойного численного интегрирования по методу прямоугольников [30].
Спектры ЭПР образцов печени лабораторных мышей содержат анизотропный синглетный сигнал (рис. 2), параметры спин-гамильтониана (g
^ = 2.0074, g
÷ï = 2.003) которого соответствуют стабильным радикалам [31-33]. Спектры ЭПР образцов почек имеют аналогичный характер.
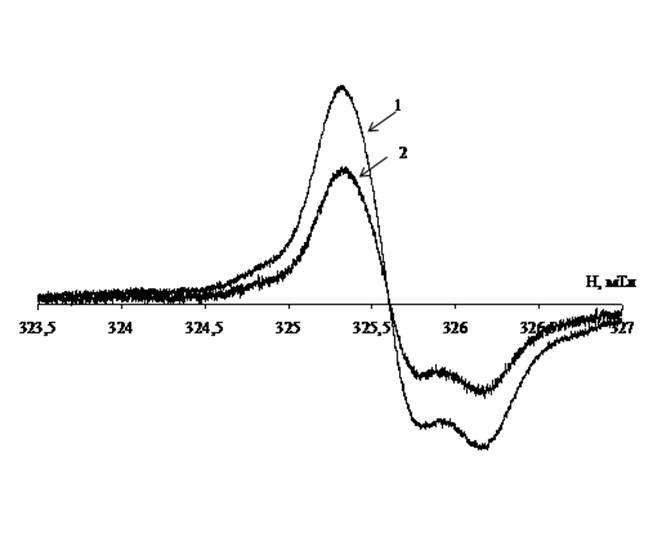 |
Рис. 2. Спектры ЭПР лиофилизированных тканей печени лабораторных мышей группы 2 (линия 1) и группы 3 (линия 2).
|
Учитывая, что метод ЭПР позволяет обнаруживать преимущественно стабильные радикалы [34], то для выявления малоустойчивых химически активных радикалов в плазме применяли метод люминол-зависимой H
2O
2-индуцированной хемилюминесценции на хемилюминотестере ЛТ-01 производства НПО «Люмин» (г.Ростов-на-Дону) в модификации [35-37]. Полученные результаты в виде максимума вспышки хемилюминесценции (МВХЛ), отражающего ингибирование процессов СРО, выражали условных единицах (усл. ед.), по отношению к вспышке в контрольных пробах без биологического материала.
Дополнительно для оценки состояния эндогенной антиоксидантной системы проводили определение антиокислительной активности (АОА) плазмы крови амперометрическим способом на анализаторе антиоксидантной активности “Яуза-01-ААА”, производства ОАО НПО “Химавтоматика” (г.Москва) по методу [38]. Способ основан на измерении электрического тока, возникающего при окислении биологического образца на поверхности рабочего электрода при определенном потенциале и сравнении полученного сигнала с сигналом стандарта, измеренного в тех же условиях, полученные результаты выражали в наноамперах в секунду (нА·с).
Статистическую обработку полученных данных осуществляли методами вариационной статистики с использованием
t-критерия Стьюдента. Достоверным считали различие при р<0,05.
Результаты и обсуждение
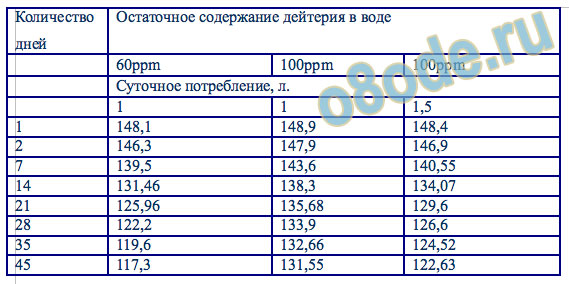
В результате проведенного исследования установлено, что наиболее низкое содержание дейтерия в биологических жидкостях и тканях зафиксировано у животных группы 3, которые получали в пищевом рационе ВМИС с пониженным содержанием дейтерия, оно было меньше на 37,3% и 38,9% в сравнении с показателями в группе 1 и 2 соответственно, что свидетельствует о достоверном (p<0,05) изменении через 30 дней после начала исследования содержания дейтерия в крови (табл. 1). При этом следует отметить, что показатели дейтерия в плазме прекращали снижаться после достижения значений в 90-100 ppm и дальнейшего его уменьшения не происходило, несмотря на более низкие показатели содержания дейтерия в потребляемой лабораторными животными ВМИС (40 ppm), что позволяет предположить наличие в организме механизмов, способных регулировать в определенном физиологическом интервале изотопный состав биологических жидкостей, предупреждая резкие перепады количественного содержания изотопов водорода в разных тканях и органах. Содержание дейтерия в лиофилизированных тканях по данным масс-спектроскопии после 4 недель употребления ВМИС с пониженным содержанием дейтерия представлено на рисунке 3.
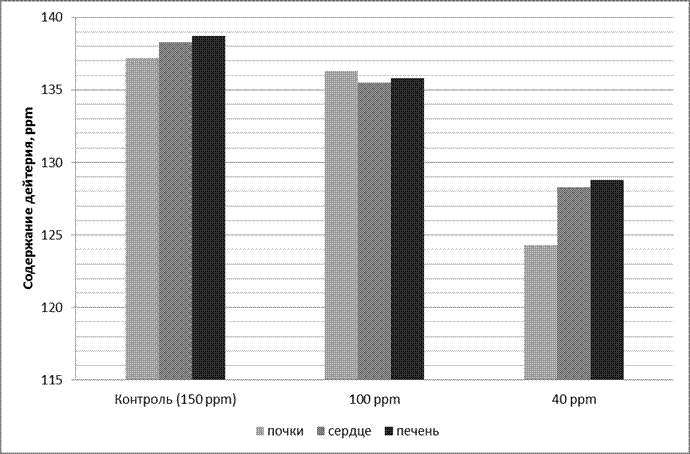 |
| Рис. 3. Содержание дейтерия в лиофилизированных тканях по данным масс-спектроскопии после 4 недель употребления ВМИС ССД. |
Таблица 1. Показатели содержания дейтерия, интенсивности свободнорадикального окисления, состояния антиоксидантной системы в крови и тканях у крыс при использовании в пищевом рационе воды с модифицированным изотопным составом.
|
Показатель
\ группа |
Содержание дейтерия плазмы, ppm |
АОА плазмы, нА·с |
МВХЛ плазмы,
усл. ед. |
ЭПР печени, ПМЦ/г |
ЭПР почки, ПМЦ/г |
Группа 1
(n=40) |
153,3±0,4
|
1246,4±23,7 |
1,993±0,024 |
960,23±56,22 |
608,61±44,01 |
Группа 2
(n=40) |
157,5±0,4 |
948,2±21,8
* |
3,058 ± 0,081* |
1584,25±112,99
* |
747,87±55,13
* |
Группа 3
(n=40) |
96,1±0,5
*,** |
1137,1±24,2 *, ** |
2,716±0,126 *,** |
1316,80±66,69
*,** |
720,66±57,07
* |
* - p<0,05 в сравнении с показателями группы № 1
** - p<0,05 в сравнении с показателями группы № 2 |
При сравнении интенсивности образования свободных радикалов в лиофилизированных органах было установлено, что печени и почках у крыс с моделированным окислительных стрессом (группы 2 и 3) наблюдалось достоверное повышение концентрации ПМЦ (табл. 1), что свидетельствует об устойчивом превалировании на клеточном уровне прооксидантных факторов над компонентами АОС, при этом более существенные изменения наблюдались в гомогенатах печени у животных в группе 2, в которых концентрация ПМЦ превышала значения контрольной группы 1 на 64,9% (p<0,05), что говорит об активном участии печени в обезвреживании токсических субстанций, образующихся при гнойно-воспалительных процессах, следствием чего становится повышение образования в гепатоцитах активных форм кислорода и формирования ОС на тканевом и органном уровнях. Следует отметить, что содержание ПМЦ в гомогенатах печени у животных 3 группы также существенно превышало аналогичные показатели в группе 1 на 37,1% (р<0,05), но было достоверно ниже показателей группы 2 на 16,9% (p<0,05), что показывает менее выраженную интенсивность СРО в их гепатоцитах и, видимо, указывает на более активную работу тканевых компонентов эндогенной АОС или меньшую токсическую нагрузку на клетки печени из очага воспаления, что, возможно, обусловлено также активацией других неспецифических защитных систем организма ВМИС с пониженным содержанием дейтерия, например ее иммуномодулирующим эффектом, ускоряющим локализацию возбудителя с помощью механизмов клеточного иммунитета.
При изучении состояния процессов СРО в гомогенатах почек были получены менее выраженные изменения у крыс с моделированным ОС, хотя они и достоверно были повышены в группе 2 (на 22,9%, p<0,05) и в группе 3 (на 18,4%, p<0,05) в сравнении с показателями контрольной группы 1. При этом достоверных отличий в обеих опытных группах 2 и 3 зафиксировано не было, что может быть связано с меньшим специфическим влиянием ВМИС с пониженным содержанием дейтерия на эндогенную АОС почек, или меньшей способностью низко- и среднемолекулярных гидрофильных токсических субстанций активировать свободнорадикальные процессы в ткани почек, известно, что некоторые из них (например мочевина, олигопептиды, мочевая кислота) могут проявлять и антиоксидантный эффект, участвуя в перехвате свободных радикалов, что снижает содержание свободных радикалов в органах выделительной системы [39].
Изменения в крови носили более значимый характер, что связано с интегрирующей функцией крови как биологической жидкости, отражающий весь спектр изменений, происходящих в организме. При исследовании плазмы крови отмечено значительное снижение ее АОА у крыс в группе 2 (на 23,9%, p<0,05), в то время как в группе 3 было отмечено гораздо меньшее снижение АОА и ее показатели достоверно превышали аналогичные значения в группе 3 (на 19,9%,p<0,05). Подобные изменения характеризуют снижение потенциала эндогенной АОС, прежде всего ее низкомолекулярного звена, во всем организме, что может приводить к развитию различных повторных патологических процессов и осложнений. В свою очередь уровень СРО в крови крыс 2 и 3 группы был достоверно (р<0,05) повышен в сравнении с контролем на 53,7% и 36,7% соответственно, что указывает на выраженную активацию прооксидантного звена, которое в свою очередь приводит к истощению низкомолекулярных антиоксидантных факторов и развитию ОС. Менее выраженные изменения прооксидантных показателей наблюдались у животных в группе 3, что можно объяснить меньшей токсической нагрузкой на их системы неспецифической защиты, вследствие, более быстрого обезвреживания в печени эндогенных токсических субстанций и иммуномодулирующего действия ВМИС с пониженным содержанием дейтерия, уменьшающего воспалительные изменения у животных.
Все перечисленные выше многообразные эффекты, связанные с воздействием на организм крыс ВМИС с пониженным содержанием дейтерия можно объяснить с помощью ряда механизмов, реализуемых in vivo на молекулярном и клеточном уровнях. Так, при потреблении ВМИС с пониженным содержанием дейтерия в клетках происходят реакции обмена Н
2О на D
2О и НDO, а также быстрый H±D обмен в гидроксильных, сульфгидрильных и аминогруппах всех органических соединений, включая белки, нуклеиновые кислоты, липиды, сахара, что может оказывать влияние на состояние низкомолекулярного звена АОС, одними из основных факторов которого являются тиоловые (-SH) и гидроксильные (-ОН) группы. Кроме того, присутствие дейтерия в биологических системах приводит к изменениям структуры и свойствам нуклеиновых кислот и белков при образовании наиболее важных для структуры макромолекулы динамических короткоживущих водородных (дейтериевых) связей, что может снижать активность и ферментов антирадикальной защиты (каталазы, супероксиддисмутазы, глутатионпероксидазы, глутатионредуктазы), уменьшая тем самым антиоксидантный потенциал организма. В свою очередь, ВМИС с пониженным содержанием дейтерия, снижая содержание дейтерия в тканях, восстанавливает работу ферментного звена АОС – как за счет непосредственного взаимодействия с –OH или –SH группами в активных центрах, так и путем активации процессов транскрипции за счет изменения колебательных моментов в цепях молекул нуклеиновых кислот и энергетического облегчения их взаимодействия с ферментами, обеспечивающими считывание генетического кода. Также при высоком содержании дейтерия происходит нарушение транспорта ионов в клеточной мембране и увеличение сопротивления биомембраны, которое особенно негативно сказывается на процессах ее возбудимости [40], поэтому использование ВМИС с пониженным содержанием дейтерия нивелирует эти отрицательные факторы и позволяет снизить вязкость мембран, повысить проницаемость для ионов, улучшить передачу сигналов первичных и вторичных мессенджеров, что, в свою очередь, восстанавливает адекватный энергообмен в тканях и снижает прооксидантную нагрузку на клеточные структуры. В данном случае эффекты ВМИС будут подобны другим (например, гормонам) косвенным антиоксидантам нашего организма.
Заключение
Таким образом, следует отметить, что в плазме крови происходит достоверное снижение концентрации дейтерия при использовании ВМИС с пониженным содержанием дейтерия, которое продолжается до значений в 90-100 ppm, в дальнейшем практически не изменяющимся. При этом ВМИС с пониженным содержанием дейтерия оказывает влияние на прооксидантно-антиоксидантную систему организма, снижая интенсивность СРО и восстанавливая потенциал эндогенной АОС. Наибольший прямой и косвенный антиоксидантный эффект ВМИС наблюдается в плазме крови и в гепатоцитах, тогда как интенсивность свободнорадикальных процессов выделительной системы изменяется менее существенно при введении ВМИС в пищевой рацион. В тоже время при воспалительных процессах положительный эффект ВМИС с пониженным содержанием дейтерия объясняется еще и ее возможным иммуномодулирующим эффектом, позволяющим уменьшить отрицательное воздействие бактериальных эндотоксических субстанций на организм. Все это позволяет рассматривать ВМИС как перспективное вещество для нутриционной коррекции дисбаланса прооксидантно-антиоксидантной системы в организме.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований, проект № 11-04-96523-р_юг_ц, государственного задания Министерства образования и науки Российской Федерации, проект № 7.369.2011, № 4.1755.2011
INFLUENCE OF ULTRALOW CONCENTRATION OF THE DEUTERIUM ON PROCESSES OF FREE RADICAL OXIDATION AT LABORATORY ANIMALS
S.S. Dzhimak, M.G. Barishev, A.A. Basov1
Kuban state university, South Scientific Centre of Russian Academy of Sciences E-mail:
jimack@mail.ru
1Kuban state medical university
Литература
1. Дубинина Е.Е. Некоторые особенности функционирования ферментативной антиоксидантной защиты плазмы крови человека //Биохимия. 1993. Т. 58. №2. С.268-273.
2. Young, I. S.; Woodside, J. V. Antioxidants in health and disease //J. Clin. Pathol. 2001. V. 54. P.176-186.
3. Скулачев В. П. Феноптоз: запрограммированная смерть организма //Биохимия. 1999. Т. 64. № 12. С.1679-1688.
4. Кулинский В.И. Активные формы кислорода и оксидативная модификация макромолекул: польза, вред и защита. // Соросовский образовательный журнал. 1999. №1. С.2-8.
5. Владимиров Ю.А. Свободные радикалы в биологических системах //Соросовский образовательный журнал. 2000. №12. С.13-19.
6. Болдырев А.А. Роль активных форм кислорода в жизнедеятельности нейрона. // Успехи физиологических наук. 2003. Т.34, № 3. С.21-34.
7. Владимиров Ю.А. Активные формы кислорода и азота: значение для диагностики профилактики и терапии. //Биохимия. 2004. Т.69, вып. 1. С.5-7.
8. Davies, K. J. A. Oxidative stress, antioxidant defenses, and damage removal, repair, and replacement systems // IUBMB Life. 2000. V. 50. P. 279-289.
9. Гомазков О.А. Окислительный стресс на молекулярном, клеточном и органном уровнях. //Биохимия. 2003. Т.68, вып. 7. С.1005-1006.
10. Stern A. Oxidative stress, Cell Activation and Viral Infection. – Basel: Birkhauser Verlag. 1994. P.35-42.
11. Балаболкин М.И., Клебанова Е.М. Роль окислительного стресса в патогенезе сосудистых осложнений диабета (лекция). //Проблемы эндокринологии. 2000. Т.46. № 6. С.29 – 34.
12. Christen Y. Oxidative stress and Alzheimer’s disease //Am. J. Clin. Nutr. 2000. V.71. P.621-629.
13. Балаболкин М.И., Креминская В.М., Клебанова Е.М. Роль окислительного стресса в патогенезе диабетической нейропатии и возможность его коррекции препаратами α-липоевой кислоты // Проблемы эндокринологии. 2005. Т. 51, № 3. С.22-33.
14. Шестакова С.А., Степанов Р.П., Григоренко Г.А., Федорова Н.В., Тишковская Ю.Н. Антиоксидантная защита и структурные изменения в головном мозге у крыс при экспериментальном сахарном диабете //Проблемы эндокринологии. 2006. Т.52, № 5. С.37-43.
15. Joshipura, K.J., Hu, F.B., Manson, J.E., Stampfer, M.J., Rimm, E.B., Speizer, F.E., Colditz, G., Ascherio, A., Rosner, B., Spiegelman, D., Willett, W.C. The effect of fruit and vegetable intake on risk for coronary heart disease //Ann. Intern. Med. 2001. V. 134. P.1106-1114.
16. Xianli Wu, Gary R. Beecher, Joanne M. Holden, David B. Haytowitz, Susan E. Gebhardt, Ronald L. Prior. Lipophilic and Hydrophilic Antioxidant Capacities of Common Foods in the United States //Journal Agricultural and Food Chemistry. 2004. Vol. 52. No. 12. P.4026-4037.
17. Тутельян В.А., Лашнева Н. В. Биологически активные вещества растительного происхождения. Катехины: пищевые источники, биодоступность, влияние на ферменты метаболизма ксенобиотиков //Вопросы питания. 2009. Т.78, № 4. С.4–20.
18. Olariu L., Petcu M., Tulcan C., Chis-Buiga I., Pup M., Florin M., Brudiu I. Deuterium depleted water- antioxidant or prooxidant? //Lucrări Stiinłifice Medicină Veterinară. 2007. Timisoara. Vol. XL. P.265-269.
19. Bild W, Năstasă V, Haulică I. In vivo and in vitro research on the biological effects of deuterium-depleted water: Influence of deuterium-depleted water on cultured cell growth //Rom J Physiol. 2004. № 41(1-2). P.53-67.
20. Somlyai G. Naturally occurring deuterium is essential for the normal growth rate of cells //FEBS Letters. 1993. Volume 317, № 1,2. P.1-4.
21. Feng-song Cong, Ya-ru Zhang, Hong-cai Sheng, Zong-huaAo, Su-yi Zhang, Ju-yong Wang Deuterium-depleted water inhibits human lung carcinoma cell growth by apoptosis //Experimental and therapeutic medicine. 2010. №1. P.277-283.
22. Bild W., Stefanescu I., Haulica I. Research concerning the radioprotective and immunostimulating effects of deuterium-depleted water //Rom J Physiol. 1999. № 36(3-4). P.205-218.
23. Раков Д.В., Ерофеева Л.М., Григоренко Д.Е. и др. Влияние воды с пониженным содержанием тяжелого стабильного изотопа водорода дейтерия и кислорода
18О на развитие лучевых повреждений при гамма - облучении в низкой дозе //Радиационная биология. Радиоэкология. 2006. Т. 46, №4. С.475-479.
24. Раков Д.В. Влияние воды с пониженным содержанием дейтерия и кислорода
18О на развитие лучевых повреждений после гамма-облучения //Авиакосмическая и экологическая медицина. 2007. Т. 41. № 3. С.36-39.
25. Колесова О.Е., Помыткин И.А. Влияние естественной концентрации тяжелых изотопологов воды на скорость генерации Н2О2 митохондриями // Бюллетень экспериментальной биологии и медицины. 2006. №11. С.514-516.
26. L. Olariu, M. Petcu, S. Cuna. The role of deuterium depleted water (ddw) administration in blood deuterium concentration in Cr (VI) intoxicated rats. Lucrări ştiinłifice medicină veterinară vol. XLIII (2), 2010. Timişoara. P.193-196
27. Пат. 2438765 Российская Федерация, МПК B01D 59/40 (2006.01). Способ получения биологически активной питьевой воды с пониженным содержанием дейтерия [Текст] / Фролов В.Ю., Барышев М.Г., Болотин С.Н., Джимак С.С.; заявители и патентообладатели государственное образовательное учреждение высшего профессионального образования "Кубанский государственный университет" (RU) – № 2010121324/05; заявл. 25.05.2010 ; опубл. 10.01.2012, Бюл. № 1.–7 с.
28. Пат. 2438766 Российская Федерация, МПК B01D 59/40 (2006.01). Способ получения биологически активной питьевой воды с пониженным содержанием дейтерия [Текст] / Фролов В.Ю., Барышев М.Г., Ломакина Л.В., Джимак С.С.; заявители и патентообладатели Учреждение Российской академии наук Южный научный центр РАН (RU), государственное образовательное учреждение высшего профессионального образования "Кубанский государственный университет" (RU) – 2010121326/05; заявл. 25.05.2010 ; опубл. 10.01.2012, Бюл. № 1.–7 с.
29. Басов А.А., Быков И.М., Федосов С.Р., Малышко В.В. «Способ хирургического моделирования окислительного стресса у лабораторных животных». Положительное решение о выдаче патента на изобретение по заявке № 2011100352/14 (000483) от 11.01.2011.
30. Бахвалов Н.С., Жидков Н.П., Кобельков Г.М.. Численные методы. М.: Физматлит, 2001, 630 с.
31. Боровик Е.С, Еременко В.В., Мильнер А.С. Лекции по магнетизму. М.: Физматлит, 2005. 512 с.
32. Ажипа Я.И. Медико-биологические аспекты применения метода электронного парамагнитного резонанса, М.: Наука, 1983, 528 с.
33. Пулатова М.К. Рихирева Г.Т., Куроптева З.В.: Электронный парамагнитный резонанс в молекулярной радиобиологии, М.: Энергоатомиздат, 1989, 232 с.
34. Владимиров Ю.А., Проскурина Е.В., Измайлов Д.Ю, Кинетическая хемилюминесценция как метод изучения реакций свободных радикалов //Биофизика. 2011. Т. 56, вып. 6. С.1081-1090.
35. Басов А.А., Павлюченко И.И., Плаксин А.М., Федосов С.Р. Использование аналогово-цифрового преобразователя в составе системы сбора и обработки информации с хемилюминитестером LT-1 //Вестн. новых мед. технологий. – 2003. Т. 10, № 4. С. 67-68.
36. Павлюченко И.И., Басов А.А., Федосов С.Р. Система лабораторной диагностики окислительного стресса. Патент на полезную модель № 54787. – Заявл. 19.01.2006; опубл. 27.07.2006 –Б.21.
37. Павлюченко И.И., Федосов С.Р., Басов А.А. Программа регистрации сигналов хемилюминотестера ЛТ-1. Свидетельство об официальной регистрации программы для ЭВМ № 2006611562. – Заявл. № 2006610783 от 16.03.2006.
38. Яшин А.Я. Инжекционно-проточная система с амперометрическим детектором для селективного определения антиоксидантов в пищевых продуктах и напитках //Рос. хим. ж. (Ж. Рос. хим. об-ва им. Д.И. Менделеева), 2008. Т. LII, № 2. С.130-135.
39. Мирхайдаров А.Р. Исследование хемилюминесценции крови и мочи у больных в критических состояниях //Матер. нац. научно-практ. конф. с международным участием «Свободные радикалы, антиоксиданты и болезни человека». Смоленск, 2001. С.212-214.
40. Лобышев В.Н., Калиниченко Л.П. Изотопные эффекты D
2О в биологических системах. М.: Наука, 1978. 215 с.


 LinkBack URL
LinkBack URL About LinkBacks
About LinkBacks


 Ответить с цитированием
Ответить с цитированием






Социальные закладки