Потенциал мембраны митохондрий, цикл Кребса, HIF-1 и реактивные виды кислорода
Потенциал мембраны митохондрий – это тема, которая меня давно интересовала. Откуда берется, какие преимущества дает организмам.
«Цикл лимонной кислоты и потенциал мембраны митохондрий необходимы для разнообразных биологических функций». Поиск отличной статьи про потенциал мембраны увенчался успехом. Гилберт Линг присовокупив к биологии электростатику и индукционные взаимодействия белков объяснял потенциал мембраны. Но биологов такие физические вопросы зачастую ставят в тупик. Эта блестящая работа, хоть не отвечает на все вопросы, стоит пристального изучения.
Как изучают подобные вещи биологи? Им нужно физически, фармакологически или как-то еще точечно подавить ту или иную функцию. Затем смотреть, что ее подавление будет означать для организма. Если содержание будет казаться вам скучным – переходите к выводам.
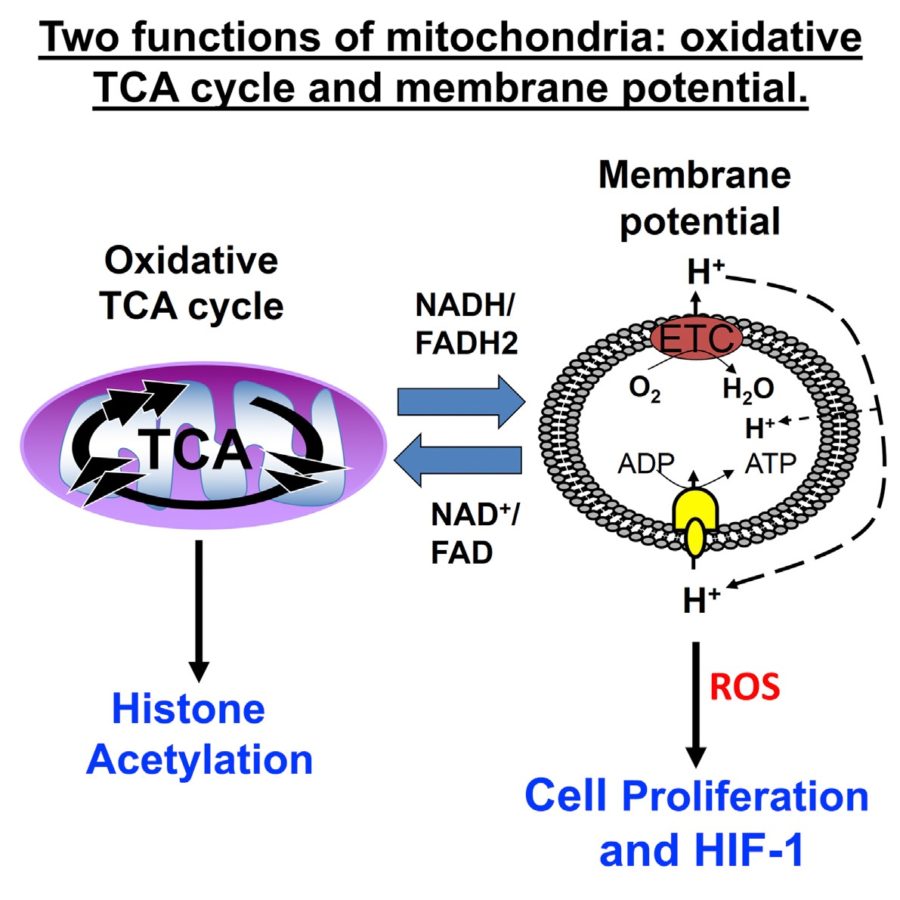
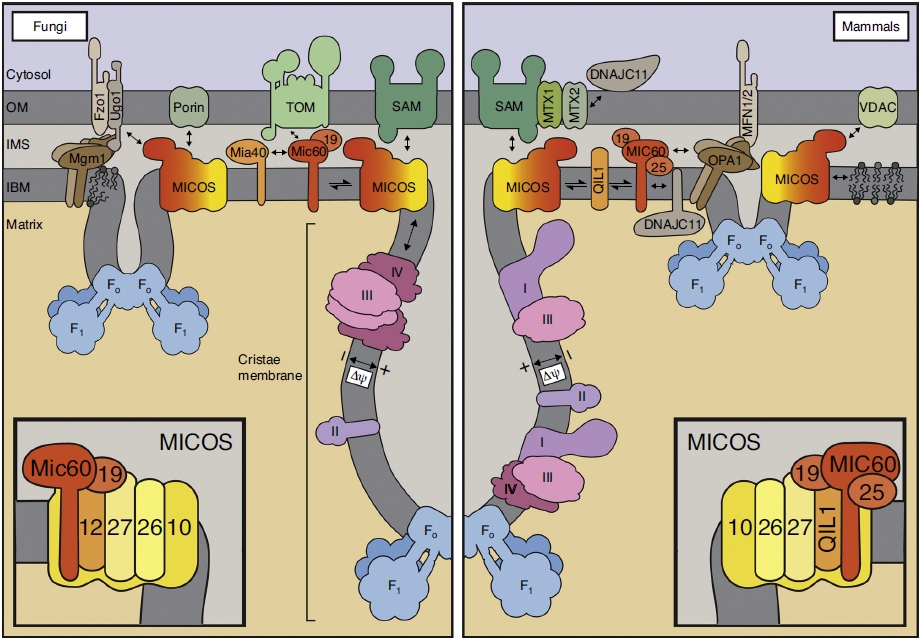
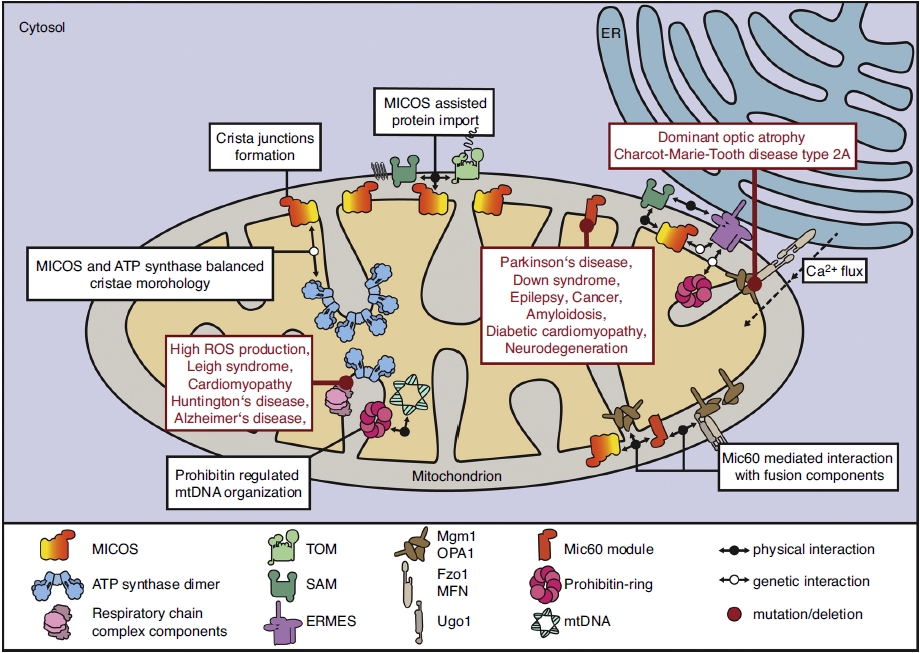
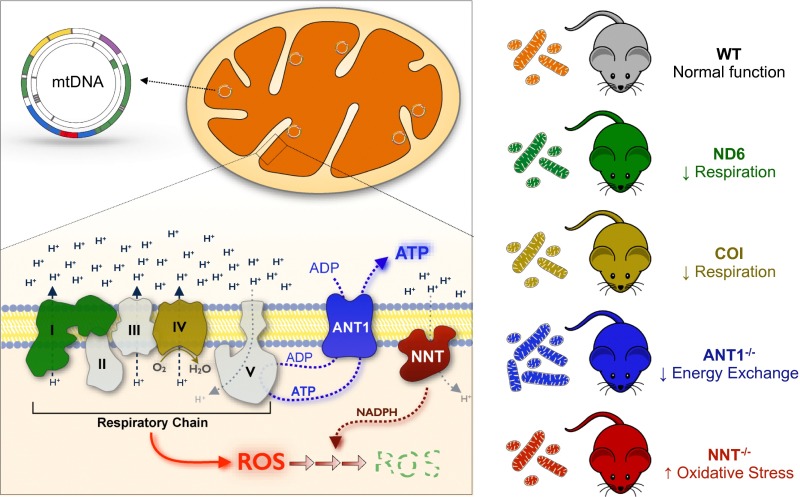
ρ0 клетки (ро-зеро клетки) – это клетки без митохондриальной ДНК (мтДНК). Если помните мою недавнюю заметку о белковых структурах митохондрий, то эти органеллы кодируют сами только 13 белков. Остальное митохондрии получают от клетки. Цикл Кресба (лимонной кислоты) создает субстраты NADH и FADH2, которые доставляют электроны дыхательной цепи митохондрий (ЭТЦ), которая использует кислород как финальный акцептор электронов. Более важно, что комплекс I, III и IV создают протоновый градиент в межмембранном пространстве, который необходим для работы АФТ-синтазы. Потенциал мембраны играют важную роль в транспорте белков из цитозоли в митохондрию. Также не стоит забывать, что митохондрия играет важную сигнальную роль для клетки. Например, реактивные виды кислорода (ROS) через окисления белковых тиолов приводят к выбросу цитрата, создающего ацетил-КоА. Ацетил-коА в цитозоле приводит к ацетилированию ДНК, то есть к эпигенетической регуляции экспрессии генов. Или белковый димер HIF-1, который отвечает за реакцию клетки на гипоксию.
В митохондрии есть фермент полимераза-γ (POLG). Подавление полимеразы-гамма приводит к потере мтДНК способности к репликации без воздействия на ДНК клетки. Подавления POLG исследователи добились доксициклином (антибиотик). Затем они генетические вывели dominant negative POLG клетки (DN-POLG), то есть клетки без мтДНК.
Потеря мтДНК снижала ацетилирование H3 гистоновых «хвостиков». При этом не воздействуя на метилирование.
Как метилирование и ацетилирование гистнов влияет на экспрессию генов читайте в заметке про метилирование. То есть мтДНК влияет на экспрессию генов самой клетки.
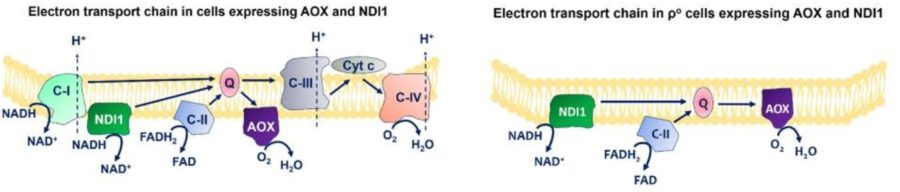
Чтобы восстановить цикл Кребса в клетках без мтДНК, исследователи «добавили» 2 белка, несуществующих у млекопитающих. От S. cerevisiae взяли NDl1 (альтернатива NADH дегидрогеназы, то есть комплексу I) и т C. Intestinalis AOX (альтернативную оксидазу), которые передают электроны, при это НЕ выкачивая протоны. NDl1 может окислять NADH, таким образом восстанавливая функцию переноса электронов комплекса I. AOX может переносить электрон от юбихинола к кислороду (пропуская комплексы III и IV). В клетках без мтДНК комплексы I, III и IV не функционируют. Так что в наших ρ0 клетках NDl1 и AOX теперь отвечают за перенос электронов, восстановление NAD+ и FAD и за восстановление активности цикла Кребса. Восстановленная активность цикла лимонной кислоты привода приводила к пролиферации DN-POLG клеток.
При этом без выкачки протонов нет работы нано-ротора АТФ-синтазы, синтеза АТФ и, de facto, теряется потенциал мембраны. Это очень глубокая находка и это же объяснял Гилберт Линг, но с помощью физики. АТФ создает потенциал мембраны. Клетки без работы АТФ синтазы вынуждены полностью полагаться на гликолиз. И когда глюкозу заменяли на галактазу, то клетка умирала.
DN-POLG клетки пытались восстановить потенциал мембраны за счет выкачки протонов через саму АТФ-синтазу. F0F1 (обычно F1F0 – это обозначения частей димера) путь протонов, для выкачки которых использовалась энергия АФТ (преобразование АТФ4- в АДФ3-), полученной за счет гликолиза. По подсчетам авторов 13% всей АФТ от гликолиза уходило на выкачку протонов через АТФ синтазу, чтобы создать потенциал мембраны. В митохондриях есть белок ATPIF1, который эндогенно блокирует подобную выкачку протонов. Этого белок уничтожали технологией CRISPR (криспер).
DN-POLG ATPIF1 knockout клетки улучшали пролиферацию, а их митохондрии восстанавливали потенциал мембраны, который в свою очередь приводит к созданию реактивных видов кислорода (ROS) и активации HIF-1 димера, отвечающего за чувствительность клетки к кислороду. Без потенциала, напомню, митохондрии не могут транспортировать белки из цитозоли клетки.
При восстановлении цикла Кребса и потенциала мембраны у клеток без мтДНК, их пролиферация возвращалась в норму.
HIF-1 димер состоит из двух частей. HIF-1α часть чувствительна кислороду, HIF-1β часть нечувствительна к кислороду. При нормальном уровне кислорода HIF-1α гидроксилируется у определенных пролиновых остатков при помощи пролил-гидроксилазы, тем самым делая ее цель деградации протеазой. Гипоксия снижает гидроксилирование HIF-1α, стабилизируя ее и димениразилированием отделяя ее от HIF-1β, что активирует гены, отвечающие за адаптацию к гипоксии. Активация HIF-1 способствует пролиферации клетки. Здесь пора салютовать Виму Хофу, монахам Туммо и всем тем, кто догадался совместить закаливание с контролируемой гипервентиляцией, которая приводит к легкой гипоксии мозга по физиологическим причинам.
Выводы:
АТФ создает потенциал мембраны митохондрий (мне нужно заставить себя расписать идеи Линга, чуть позже поясню почему);
Клетки без мтДНК имеют ту же продолжительность жизни при восстановленных цикле Кребса и потенциале мембраны митохондрий;
Для создания реактивных видов кислорода и стабилизации HIF-1 необходим большой потенциал мембраны;
Реактивные виды кислорода жизненно необходимы для ряда функцией, в то числе для экспрессии генов за счет ацетилирования ДНК;
Стабилизация HIF-1α приводит к пролиферации клетки. Связь мне еще до конца не ясна, но это говорит о том, что пранаямы работают.


 LinkBack URL
LinkBack URL About LinkBacks
About LinkBacks


 Ответить с цитированием
Ответить с цитированием













Социальные закладки